ในวงการแพทย์สมัยใหม่ ยาปฏิชีวนะได้รับการพิสูจน์แล้วว่าเป็นหนึ่งในความก้าวหน้าที่สำคัญที่สุด โดยช่วยลดอัตราการเกิดและการเสียชีวิตที่เกี่ยวข้องกับการติดเชื้อจุลินทรีย์ได้อย่างมาก ความสามารถในการเปลี่ยนแปลงผลลัพธ์ทางคลินิกของการติดเชื้อแบคทีเรียได้ช่วยยืดอายุขัยของผู้ป่วยจำนวนนับไม่ถ้วน ยาปฏิชีวนะมีความสำคัญอย่างยิ่งในขั้นตอนทางการแพทย์ที่ซับซ้อน รวมถึงการผ่าตัด การฝังอุปกรณ์ การปลูกถ่าย และเคมีบำบัด อย่างไรก็ตาม การเกิดขึ้นของเชื้อโรคดื้อยาปฏิชีวนะเป็นเรื่องที่น่ากังวลมากขึ้นเรื่อยๆ ซึ่งลดประสิทธิภาพของยาเหล่านี้ลงเมื่อเวลาผ่านไป มีการบันทึกกรณีการดื้อยาปฏิชีวนะในยาปฏิชีวนะทุกประเภทเนื่องจากการกลายพันธุ์ของจุลินทรีย์ แรงกดดันจากการคัดเลือกโดยยาต้านจุลินทรีย์มีส่วนทำให้เกิดสายพันธุ์ดื้อยา ซึ่งเป็นความท้าทายที่สำคัญต่อสุขภาพทั่วโลก
เพื่อต่อสู้กับปัญหาการดื้อยาต้านจุลชีพที่เป็นปัญหาเร่งด่วน จำเป็นอย่างยิ่งที่จะต้องนำนโยบายควบคุมการติดเชื้อที่มีประสิทธิภาพมาใช้ เพื่อลดการแพร่กระจายของเชื้อโรคที่ดื้อยา ควบคู่ไปกับการลดการใช้ยาปฏิชีวนะ นอกจากนี้ ยังมีความจำเป็นเร่งด่วนที่จะต้องหาวิธีการรักษาทางเลือกอื่น การบำบัดด้วยออกซิเจนความดันสูง (HBOT) ได้กลายเป็นวิธีการรักษาที่มีแนวโน้มที่ดีในบริบทนี้ โดยเกี่ยวข้องกับการสูดดมออกซิเจน 100% ที่ระดับความดันที่กำหนดในช่วงระยะเวลาหนึ่ง HBOT สามารถใช้เป็นทั้งการรักษาหลักหรือการรักษาเสริมสำหรับการติดเชื้อ และอาจเป็นความหวังใหม่ในการรักษาการติดเชื้อเฉียบพลันที่เกิดจากเชื้อโรคที่ดื้อยาปฏิชีวนะ
การบำบัดด้วยออกซิเจนความดันสูง (HBOT) กำลังถูกนำมาใช้มากขึ้นเรื่อยๆ ทั้งในฐานะวิธีการรักษาหลักหรือทางเลือกสำหรับภาวะต่างๆ รวมถึงการอักเสบ พิษจากคาร์บอนมอนอกไซด์ แผลเรื้อรัง โรคหลอดเลือดตีบ และการติดเชื้อ การประยุกต์ใช้ HBOT ในการรักษาการติดเชื้อนั้นมีมากมายและให้ประโยชน์อย่างมหาศาลแก่ผู้ป่วย

การประยุกต์ใช้การบำบัดด้วยออกซิเจนความดันสูงในการรักษาการติดเชื้อในทางคลินิก
หลักฐานในปัจจุบันสนับสนุนอย่างแข็งขันถึงการใช้ HBOT ทั้งในฐานะการรักษาแบบเดี่ยวและการรักษาเสริม ซึ่งให้ประโยชน์อย่างมากต่อผู้ป่วยที่ติดเชื้อ ในระหว่างการรักษาด้วย HBOT ความดันออกซิเจนในเลือดแดงสามารถเพิ่มขึ้นได้ถึง 2000 มิลลิเมตรปรอท และความแตกต่างของความดันออกซิเจนในเนื้อเยื่อที่สูงขึ้นนี้สามารถเพิ่มระดับออกซิเจนในเนื้อเยื่อได้ถึง 500 มิลลิเมตรปรอท ผลกระทบดังกล่าวมีคุณค่าอย่างยิ่งในการส่งเสริมการรักษาการอักเสบและการหยุดชะงักของจุลหลอดเลือดที่พบในสภาพแวดล้อมที่มีภาวะขาดเลือด ตลอดจนการจัดการภาวะกลุ่มอาการช่องกล้ามเนื้อบวม
การบำบัดด้วยออกซิเจนความดันสูง (HBOT) ยังสามารถส่งผลกระทบต่อภาวะต่างๆ ที่ต้องพึ่งพาระบบภูมิคุ้มกัน งานวิจัยชี้ให้เห็นว่า HBOT สามารถยับยั้งกลุ่มอาการภูมิคุ้มกันทำลายตนเองและการตอบสนองทางภูมิคุ้มกันที่เกิดจากแอนติเจน ช่วยรักษาความทนทานต่อการปลูกถ่ายอวัยวะโดยการลดการไหลเวียนของลิมโฟไซต์และเม็ดเลือดขาวในขณะที่ปรับการตอบสนองทางภูมิคุ้มกัน นอกจากนี้ HBOT ยัง...ช่วยในการรักษาในการรักษาแผลเรื้อรังที่ผิวหนังโดยกระตุ้นการสร้างหลอดเลือดใหม่ ซึ่งเป็นกระบวนการสำคัญที่ช่วยให้แผลหายเร็วขึ้น การรักษานี้ยังช่วยกระตุ้นการสร้างคอลลาเจน ซึ่งเป็นขั้นตอนสำคัญในการรักษาบาดแผลอีกด้วย
ต้องให้ความสนใจเป็นพิเศษกับการติดเชื้อบางชนิด โดยเฉพาะอย่างยิ่งการติดเชื้อลึกและรักษายาก เช่น เนื้อเยื่ออักเสบเน่าตาย กระดูกอักเสบ การติดเชื้อเนื้อเยื่ออ่อนเรื้อรัง และเยื่อบุหัวใจอักเสบจากการติดเชื้อ หนึ่งในการประยุกต์ใช้ HBOT ทางคลินิกที่พบบ่อยที่สุดคือการรักษาการติดเชื้อที่ผิวหนังและเนื้อเยื่ออ่อน และกระดูกอักเสบที่เกี่ยวข้องกับระดับออกซิเจนต่ำ ซึ่งมักเกิดจากแบคทีเรียที่ไม่ใช้ออกซิเจนหรือแบคทีเรียดื้อยา
1. การติดเชื้อที่เท้าในผู้ป่วยเบาหวาน
เท้าเบาหวานแผลเป็นภาวะแทรกซ้อนที่พบได้บ่อยในผู้ป่วยเบาหวาน โดยพบได้ถึง 25% ของผู้ป่วยกลุ่มนี้ การติดเชื้อมักเกิดขึ้นในแผลเหล่านี้ (คิดเป็น 40%-80% ของกรณีทั้งหมด) และนำไปสู่การเพิ่มขึ้นของอัตราการเจ็บป่วยและเสียชีวิต การติดเชื้อที่เท้าในผู้ป่วยเบาหวาน (DFIs) มักเป็นการติดเชื้อแบบหลายชนิด โดยมีเชื้อแบคทีเรียแบบไม่ใช้ออกซิเจนหลายชนิดเป็นสาเหตุ ปัจจัยต่างๆ เช่น ความบกพร่องในการทำงานของไฟโบรบลาสต์ ปัญหาการสร้างคอลลาเจน กลไกภูมิคุ้มกันของเซลล์ และการทำงานของฟาโกไซต์ สามารถขัดขวางการสมานแผลในผู้ป่วยเบาหวานได้ การศึกษาหลายชิ้นระบุว่าการขาดออกซิเจนในผิวหนังเป็นปัจจัยเสี่ยงสำคัญที่ทำให้ต้องตัดอวัยวะเนื่องจากการติดเชื้อที่เท้าในผู้ป่วยเบาหวาน
เป็นหนึ่งในทางเลือกปัจจุบันสำหรับการรักษา DFIมีรายงานว่าการบำบัดด้วยออกซิเจนความดันสูง (HBOT) ช่วยเพิ่มอัตราการหายของแผลที่เท้าของผู้ป่วยเบาหวานได้อย่างมีนัยสำคัญ ส่งผลให้ลดความจำเป็นในการตัดขาและการผ่าตัดที่ซับซ้อน นอกจากจะช่วยลดความจำเป็นในการใช้วิธีการที่ต้องใช้ทรัพยากรมาก เช่น การผ่าตัดปลูกถ่ายผิวหนังแล้ว ยังมีค่าใช้จ่ายต่ำกว่าและมีผลข้างเคียงน้อยกว่าเมื่อเทียบกับการผ่าตัด งานวิจัยของ Chen et al. แสดงให้เห็นว่าการบำบัดด้วย HBOT มากกว่า 10 ครั้ง ส่งผลให้อัตราการหายของแผลในผู้ป่วยเบาหวานดีขึ้นถึง 78.3%
2. การติดเชื้อเนื้อเยื่ออ่อนที่ทำให้เกิดเนื้อตาย
การติดเชื้อเนื้อเยื่ออ่อนที่ทำให้เกิดเนื้อตาย (NSTIs) มักเกิดจากเชื้อแบคทีเรียหลายชนิด โดยทั่วไปเกิดจากเชื้อแบคทีเรียทั้งแบบใช้ออกซิเจนและไม่ใช้ออกซิเจน และมักเกี่ยวข้องกับการเกิดก๊าซ แม้ว่า NSTIs จะค่อนข้างหายาก แต่ก็มีอัตราการเสียชีวิตสูงเนื่องจากการลุกลามอย่างรวดเร็ว การวินิจฉัยและการรักษาที่ทันท่วงทีและเหมาะสมเป็นกุญแจสำคัญในการบรรลุผลลัพธ์ที่ดี และการบำบัดด้วยออกซิเจนความดันสูง (HBOT) ได้รับการแนะนำให้เป็นวิธีการเสริมในการจัดการ NSTIs แม้ว่าจะยังคงมีข้อถกเถียงเกี่ยวกับการใช้ HBOT ใน NSTIs เนื่องจากขาดการศึกษาแบบควบคุมเชิงเปรียบเทียบในอนาคตหลักฐานบ่งชี้ว่าอาจมีความสัมพันธ์กับอัตราการรอดชีวิตที่ดีขึ้นและการรักษาอวัยวะในผู้ป่วย NSTIการศึกษาแบบย้อนหลังแสดงให้เห็นว่าอัตราการเสียชีวิตลดลงอย่างมีนัยสำคัญในผู้ป่วย NSTI ที่ได้รับการรักษาด้วย HBOT
1.3 การติดเชื้อที่แผลผ่าตัด
การติดเชื้อที่แผลผ่าตัดสามารถจำแนกได้ตามตำแหน่งทางกายวิภาคของการติดเชื้อ และอาจเกิดจากเชื้อโรคต่างๆ รวมถึงแบคทีเรียทั้งแบบใช้ออกซิเจนและไม่ใช้ออกซิเจน แม้ว่าจะมีการพัฒนามาตรการควบคุมการติดเชื้อ เช่น เทคนิคการฆ่าเชื้อ การใช้ยาปฏิชีวนะเพื่อป้องกัน และการปรับปรุงวิธีการผ่าตัด แต่การติดเชื้อที่แผลผ่าตัดยังคงเป็นภาวะแทรกซ้อนที่เกิดขึ้นอย่างต่อเนื่อง
มีการศึกษาวิจัยสำคัญชิ้นหนึ่งที่ตรวจสอบประสิทธิภาพของ HBOT ในการป้องกันการติดเชื้อที่แผลผ่าตัดลึก (SSI) ในการผ่าตัดกระดูกสันหลังคดจากความผิดปกติของระบบประสาทและกล้ามเนื้อ การรักษาด้วย HBOT ก่อนผ่าตัดอาจช่วยลดอุบัติการณ์ของการติดเชื้อที่แผลผ่าตัดได้อย่างมีนัยสำคัญและช่วยให้แผลหายเร็วขึ้น การรักษาแบบไม่รุกรานนี้สร้างสภาพแวดล้อมที่ระดับออกซิเจนในเนื้อเยื่อแผลสูงขึ้น ซึ่งเกี่ยวข้องกับการฆ่าเชื้อโรคด้วยกระบวนการออกซิเดชั่น นอกจากนี้ยังช่วยแก้ไขปัญหาระดับออกซิเจนในเลือดต่ำซึ่งเป็นสาเหตุของการติดเชื้อที่แผลผ่าตัด นอกเหนือจากกลยุทธ์การควบคุมการติดเชื้ออื่นๆ แล้ว HBOT ยังได้รับการแนะนำเป็นพิเศษสำหรับการผ่าตัดที่มีการปนเปื้อนเล็กน้อย เช่น การผ่าตัดลำไส้ใหญ่และทวารหนัก
1.4 แผลไหม้
แผลไหม้เป็นบาดแผลที่เกิดจากความร้อนสูง กระแสไฟฟ้า สารเคมี หรือรังสี และอาจทำให้มีอัตราการเจ็บป่วยและเสียชีวิตสูง การบำบัดด้วยออกซิเจนความดันสูง (HBOT) มีประโยชน์ในการรักษาแผลไหม้โดยการเพิ่มระดับออกซิเจนในเนื้อเยื่อที่เสียหาย แม้ว่าการศึกษาในสัตว์และในมนุษย์จะให้ผลลัพธ์ที่แตกต่างกันเกี่ยวกับเรื่องนี้ก็ตามประสิทธิภาพของ HBOT ในการรักษาแผลไฟไหม้จากการศึกษาในผู้ป่วยแผลไฟไหม้ 125 ราย พบว่า การบำบัดด้วยออกซิเจนความดันสูง (HBOT) ไม่ส่งผลกระทบอย่างมีนัยสำคัญต่ออัตราการเสียชีวิตหรือจำนวนการผ่าตัด แต่ช่วยลดระยะเวลาการหายของแผลโดยเฉลี่ย (19.7 วัน เทียบกับ 43.8 วัน) การบูรณาการ HBOT กับการจัดการแผลไฟไหม้แบบครบวงจร สามารถควบคุมภาวะติดเชื้อในผู้ป่วยแผลไฟไหม้ได้อย่างมีประสิทธิภาพ ส่งผลให้ระยะเวลาการหายของแผลสั้นลงและลดความต้องการของเหลว อย่างไรก็ตาม จำเป็นต้องมีการวิจัยเชิงลึกเพิ่มเติมในอนาคตเพื่อยืนยันบทบาทของ HBOT ในการจัดการแผลไฟไหม้ที่รุนแรง
1.5 โรคกระดูกอักเสบ
โรคกระดูกอักเสบเป็นภาวะติดเชื้อในกระดูกหรือไขกระดูก ซึ่งมักเกิดจากเชื้อแบคทีเรีย การรักษาโรคกระดูกอักเสบอาจเป็นเรื่องยาก เนื่องจากกระดูกมีเลือดไปเลี้ยงค่อนข้างน้อย และยาปฏิชีวนะแทรกซึมเข้าไปในไขกระดูกได้จำกัด โรคกระดูกอักเสบเรื้อรังมีลักษณะเฉพาะคือ เชื้อโรคยังคงอยู่ มีการอักเสบเล็กน้อย และมีการตายของเนื้อเยื่อกระดูก โรคกระดูกอักเสบที่ไม่ตอบสนองต่อการรักษา หมายถึงการติดเชื้อในกระดูกเรื้อรังที่ยังคงอยู่หรือกลับมาเป็นซ้ำอีก แม้จะได้รับการรักษาอย่างเหมาะสมแล้วก็ตาม
การบำบัดด้วยออกซิเจนความดันสูง (HBOT) ได้แสดงให้เห็นว่าสามารถเพิ่มระดับออกซิเจนในเนื้อเยื่อกระดูกที่ติดเชื้อได้อย่างมีนัยสำคัญ งานวิจัยหลายชิ้นทั้งในกลุ่มผู้ป่วยและกลุ่มตัวอย่างบ่งชี้ว่า HBOT ช่วยปรับปรุงผลลัพธ์ทางคลินิกของผู้ป่วยโรคกระดูกอักเสบ ดูเหมือนว่า HBOT จะออกฤทธิ์ผ่านกลไกต่างๆ รวมถึงการเพิ่มกิจกรรมการเผาผลาญ การยับยั้งเชื้อแบคทีเรีย การเพิ่มประสิทธิภาพของยาปฏิชีวนะ การลดการอักเสบ และการส่งเสริมการรักษากระบวนการต่างๆ หลังการรักษาด้วย HBOT ผู้ป่วยโรคกระดูกอักเสบเรื้อรังที่ไม่ตอบสนองต่อการรักษา 60% ถึง 85% แสดงสัญญาณของการยับยั้งการติดเชื้อ
1.6 การติดเชื้อรา
ทั่วโลกมีผู้ป่วยติดเชื้อราเรื้อรังหรือติดเชื้อราแบบรุนแรงมากกว่า 3 ล้านคน ทำให้มีผู้เสียชีวิตมากกว่า 600,000 รายต่อปี ผลการรักษาการติดเชื้อรานั้นมักไม่ดีเท่าที่ควรเนื่องจากปัจจัยต่างๆ เช่น ภาวะภูมิคุ้มกันบกพร่อง โรคประจำตัว และลักษณะความรุนแรงของเชื้อก่อโรค การบำบัดด้วยออกซิเจนความดันสูง (HBOT) กำลังเป็นทางเลือกการรักษาที่น่าสนใจสำหรับการติดเชื้อราอย่างรุนแรง เนื่องจากมีความปลอดภัยและไม่รุกรานร่างกาย การศึกษาต่างๆ ชี้ให้เห็นว่า HBOT อาจมีประสิทธิภาพต่อเชื้อราก่อโรค เช่น Aspergillus และ Mycobacterium tuberculosis
การบำบัดด้วยออกซิเจนความดันสูง (HBOT) ช่วยส่งเสริมฤทธิ์ต้านเชื้อราโดยการยับยั้งการก่อตัวของไบโอฟิล์มของเชื้อรา Aspergillus โดยพบประสิทธิภาพที่เพิ่มขึ้นในสายพันธุ์ที่ขาดจีน superoxide dismutase (SOD) สภาวะที่มีออกซิเจนต่ำในระหว่างการติดเชื้อราเป็นอุปสรรคต่อการนำส่งยาต้านเชื้อรา ทำให้ระดับออกซิเจนที่เพิ่มขึ้นจากการบำบัดด้วยออกซิเจนความดันสูง (HBOT) เป็นวิธีการรักษาที่มีประโยชน์ แต่จำเป็นต้องมีการวิจัยเพิ่มเติม
คุณสมบัติต้านจุลชีพของ HBOT
สภาพแวดล้อมที่มีออกซิเจนสูงที่เกิดจากการบำบัดด้วยออกซิเจนความดันสูง (HBOT) ก่อให้เกิดการเปลี่ยนแปลงทางสรีรวิทยาและชีวเคมีที่กระตุ้นคุณสมบัติในการต้านเชื้อแบคทีเรีย ทำให้เป็นวิธีการรักษาเสริมที่มีประสิทธิภาพสำหรับการติดเชื้อ HBOT แสดงให้เห็นผลลัพธ์ที่น่าทึ่งต่อแบคทีเรียแอโรบิกและโดยเฉพาะอย่างยิ่งแบคทีเรียแอนแอโรบิก ผ่านกลไกต่างๆ เช่น การฆ่าเชื้อแบคทีเรียโดยตรง การเสริมสร้างการตอบสนองของระบบภูมิคุ้มกัน และผลเสริมฤทธิ์กับสารต้านจุลชีพเฉพาะชนิด
2.1 ผลต้านเชื้อแบคทีเรียโดยตรงของ HBOT
ฤทธิ์ต้านแบคทีเรียโดยตรงของ HBOT ส่วนใหญ่เกิดจากการสร้างอนุมูลอิสระ (ROS) ซึ่งรวมถึงซูเปอร์ออกไซด์แอนไอออน ไฮโดรเจนเปอร์ออกไซด์ ไฮดรอกซิลแรดิคัล และไฮดรอกซิลไอออน ซึ่งทั้งหมดนี้เกิดขึ้นในระหว่างกระบวนการเผาผลาญภายในเซลล์
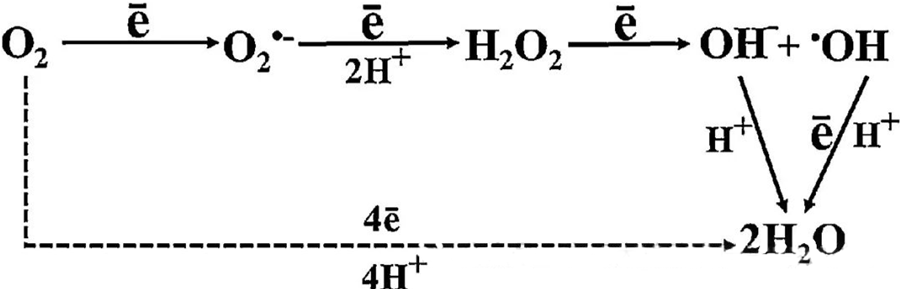
ปฏิสัมพันธ์ระหว่าง O₂ และส่วนประกอบของเซลล์มีความสำคัญอย่างยิ่งต่อการทำความเข้าใจว่า ROS เกิดขึ้นได้อย่างไรภายในเซลล์ ภายใต้สภาวะบางอย่างที่เรียกว่าภาวะเครียดออกซิเดชัน ความสมดุลระหว่างการก่อตัวและการสลายตัวของ ROS จะถูกรบกวน ส่งผลให้ระดับ ROS ในเซลล์สูงขึ้น การผลิตซูเปอร์ออกไซด์ (O₂⁻) ถูกเร่งปฏิกิริยาโดยเอนไซม์ซูเปอร์ออกไซด์ดิสมิวเทส ซึ่งจะเปลี่ยน O₂⁻ ให้เป็นไฮโดรเจนเปอร์ออกไซด์ (H₂O₂) การเปลี่ยนแปลงนี้จะถูกขยายให้มากขึ้นโดยปฏิกิริยาเฟนตัน ซึ่งออกซิไดซ์ Fe²⁺ เพื่อสร้างอนุมูลไฮดรอกซิล (·OH) และ Fe³⁺ จึงเริ่มต้นลำดับปฏิกิริยาออกซิเดชัน-รีดักชันที่เป็นอันตรายของการก่อตัวของ ROS และความเสียหายของเซลล์
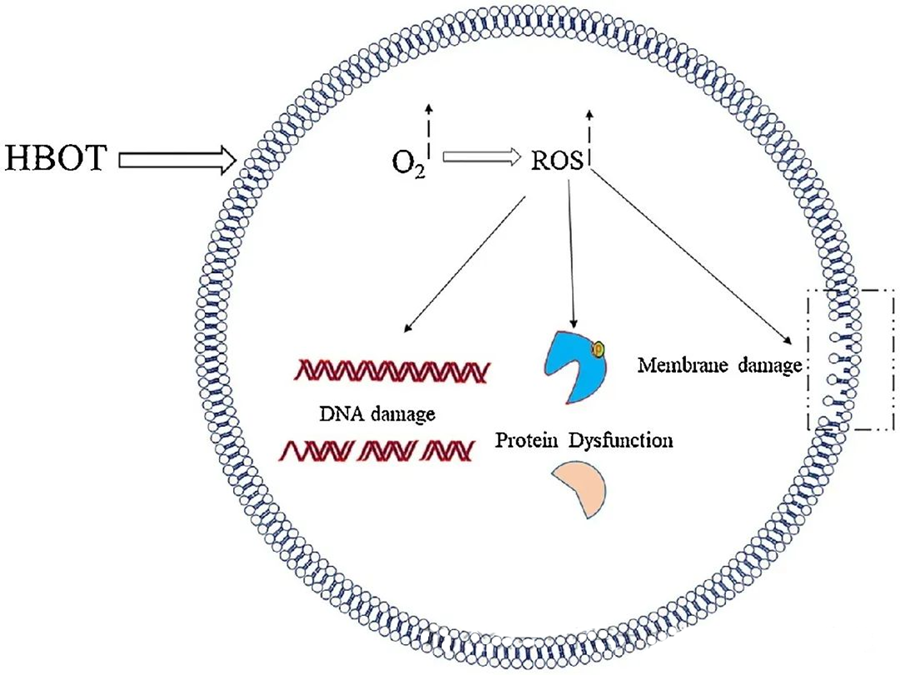
ผลกระทบที่เป็นพิษของ ROS มุ่งเป้าไปที่ส่วนประกอบสำคัญของเซลล์ เช่น DNA, RNA, โปรตีน และไขมัน โดยเฉพาะอย่างยิ่ง DNA เป็นเป้าหมายหลักของความเป็นพิษที่เกิดจาก H₂O₂ เนื่องจากมันทำลายโครงสร้างดีออกซีไรโบสและทำลายองค์ประกอบของเบส ความเสียหายทางกายภาพที่เกิดจาก ROS ขยายไปถึงโครงสร้างเกลียวของ DNA ซึ่งอาจเป็นผลมาจากการเกิดปฏิกิริยาออกซิเดชันของไขมันที่ถูกกระตุ้นโดย ROS สิ่งนี้เน้นย้ำถึงผลเสียของระดับ ROS ที่สูงขึ้นภายในระบบชีวภาพ
ฤทธิ์ต้านจุลชีพของ ROS
ROS มีบทบาทสำคัญในการยับยั้งการเจริญเติบโตของจุลินทรีย์ ดังที่แสดงให้เห็นผ่านการสร้าง ROS ที่เกิดจาก HBOT ผลกระทบที่เป็นพิษของ ROS จะมุ่งเป้าไปที่ส่วนประกอบของเซลล์โดยตรง เช่น DNA โปรตีน และไขมัน ความเข้มข้นสูงของสารออกซิเจนที่ออกฤทธิ์สามารถทำลายไขมันได้โดยตรง นำไปสู่การเกิดปฏิกิริยาออกซิเดชันของไขมัน กระบวนการนี้จะทำลายความสมบูรณ์ของเยื่อหุ้มเซลล์ และส่งผลให้การทำงานของตัวรับและโปรตีนที่เกี่ยวข้องกับเยื่อหุ้มเซลล์ลดลง
นอกจากนี้ โปรตีนซึ่งเป็นเป้าหมายโมเลกุลที่สำคัญของ ROS ยัง undergoes การเปลี่ยนแปลงออกซิเดชันเฉพาะที่ตำแหน่งกรดอะมิโนต่างๆ เช่น ซิสเทอีน เมไทโอนีน ไทโรซีน ฟีนิลอะลานีน และทริปโตเฟน ตัวอย่างเช่น มีการแสดงให้เห็นว่า HBOT กระตุ้นให้เกิดการเปลี่ยนแปลงออกซิเดชันในโปรตีนหลายชนิดใน E. coli รวมถึง elongation factor G และ DnaK ซึ่งส่งผลต่อการทำงานของเซลล์
เสริมสร้างภูมิคุ้มกันด้วยการบำบัดด้วยออกซิเจนความดันสูง (HBOT)
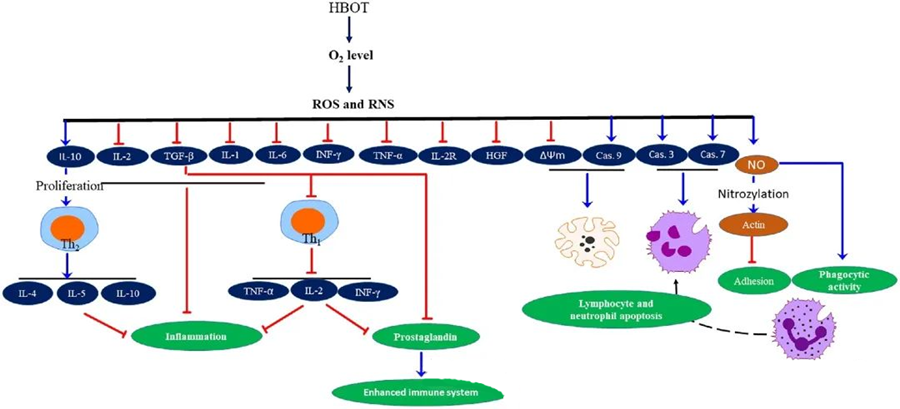
คุณสมบัติต้านการอักเสบของ HBOTมีการบันทึกไว้แล้วว่าการบำบัดด้วยออกซิเจนความดันสูง (HBOT) มีความสำคัญอย่างยิ่งในการบรรเทาความเสียหายของเนื้อเยื่อและยับยั้งการลุกลามของการติดเชื้อ HBOT ส่งผลกระทบอย่างมากต่อการแสดงออกของไซโตไคน์และสารควบคุมการอักเสบอื่นๆ ซึ่งมีอิทธิพลต่อการตอบสนองของระบบภูมิคุ้มกัน ระบบการทดลองต่างๆ สังเกตเห็นการเปลี่ยนแปลงที่แตกต่างกันในการแสดงออกของยีนและการสร้างโปรตีนหลังการบำบัดด้วย HBOT ซึ่งอาจเพิ่มขึ้นหรือลดลงของปัจจัยการเจริญเติบโตและไซโตไคน์
ในระหว่างกระบวนการ HBOT ระดับออกซิเจนที่เพิ่มขึ้นจะกระตุ้นการตอบสนองของเซลล์หลายอย่าง เช่น การยับยั้งการปล่อยสารสื่อกลางที่ก่อให้เกิดการอักเสบ และส่งเสริมการตายของเซลล์เม็ดเลือดขาวชนิดลิมโฟไซต์และนิวโทรฟิล โดยรวมแล้ว การกระทำเหล่านี้ช่วยเสริมกลไกการต่อต้านจุลชีพของระบบภูมิคุ้มกัน จึงช่วยให้การรักษาการติดเชื้อเป็นไปได้ง่ายขึ้น
นอกจากนี้ การศึกษาต่างๆ ชี้ให้เห็นว่าระดับออกซิเจนที่เพิ่มขึ้นระหว่างการบำบัดด้วยออกซิเจนความดันสูง (HBOT) สามารถลดการแสดงออกของไซโตไคน์ที่ก่อให้เกิดการอักเสบ ได้แก่ อินเตอร์เฟรอนแกมมา (IFN-γ), อินเตอร์ลิวคิน-1 (IL-1) และอินเตอร์ลิวคิน-6 (IL-6) การเปลี่ยนแปลงเหล่านี้ยังรวมถึงการลดอัตราส่วนของเซลล์ T CD4:CD8 และการปรับเปลี่ยนตัวรับที่ละลายได้อื่นๆ ซึ่งท้ายที่สุดจะเพิ่มระดับอินเตอร์ลิวคิน-10 (IL-10) ซึ่งมีความสำคัญอย่างยิ่งในการต่อต้านการอักเสบและส่งเสริมการรักษา
ฤทธิ์ต้านจุลชีพของ HBOT เกี่ยวข้องกับกลไกทางชีวภาพที่ซับซ้อน มีรายงานว่าทั้งซูเปอร์ออกไซด์และความดันสูงส่งเสริมฤทธิ์ต้านแบคทีเรียและการตายของเซลล์เม็ดเลือดขาวชนิดนิวโทรฟิลที่เกิดจาก HBOT อย่างไม่สม่ำเสมอ หลังจากการรักษาด้วย HBOT ระดับออกซิเจนที่เพิ่มขึ้นอย่างมากจะช่วยเพิ่มความสามารถในการฆ่าเชื้อแบคทีเรียของเซลล์เม็ดเลือดขาวชนิดนิวโทรฟิล ซึ่งเป็นส่วนประกอบสำคัญของการตอบสนองทางภูมิคุ้มกัน นอกจากนี้ HBOT ยังยับยั้งการยึดเกาะของเซลล์เม็ดเลือดขาวชนิดนิวโทรฟิล ซึ่งเกิดจากการโต้ตอบระหว่าง β-อินทิกรินบนเซลล์เม็ดเลือดขาวชนิดนิวโทรฟิลกับโมเลกุลการยึดเกาะระหว่างเซลล์ (ICAM) บนเซลล์เยื่อบุหลอดเลือด HBOT ยับยั้งการทำงานของ β-2 อินทิกริน (Mac-1, CD11b/CD18) บนเซลล์เม็ดเลือดขาวชนิดนิวโทรฟิลผ่านกระบวนการที่เกี่ยวข้องกับไนตริกออกไซด์ (NO) ซึ่งมีส่วนช่วยในการเคลื่อนที่ของเซลล์เม็ดเลือดขาวชนิดนิวโทรฟิลไปยังบริเวณที่ติดเชื้อ
การจัดเรียงโครงสร้างไซโทสเกเลตันใหม่ที่แม่นยำมีความจำเป็นสำหรับนิวโทรฟิลในการกลืนกินเชื้อโรคได้อย่างมีประสิทธิภาพ การเติมหมู่ไนโตรซิลลงบนแอคติน (S-nitrosylation) ได้แสดงให้เห็นว่าสามารถกระตุ้นการสร้างพอลิเมอร์ของแอคติน ซึ่งอาจช่วยอำนวยความสะดวกในการกลืนกินของนิวโทรฟิลหลังจากได้รับการบำบัดด้วยออกซิเจนความดันสูง (HBOT) นอกจากนี้ HBOT ยังส่งเสริมการเกิดอะพอพโทซิสในเซลล์ทีของมนุษย์ผ่านทางวิถีไมโทคอนเดรีย โดยมีรายงานว่าการตายของลิมโฟไซต์เพิ่มขึ้นอย่างรวดเร็วหลังการบำบัดด้วย HBOT การปิดกั้นแคสเปส-9 โดยไม่ส่งผลกระทบต่อแคสเปส-8 ได้แสดงให้เห็นถึงผลกระทบในการปรับภูมิคุ้มกันของ HBOT
ผลเสริมฤทธิ์กันของการบำบัดด้วยออกซิเจนความดันสูงร่วมกับสารต้านจุลชีพ
ในทางคลินิก การบำบัดด้วยออกซิเจนความดันสูง (HBOT) มักใช้ร่วมกับยาปฏิชีวนะเพื่อต่อสู้กับการติดเชื้อได้อย่างมีประสิทธิภาพ สภาวะที่มีออกซิเจนสูงที่เกิดขึ้นระหว่างการบำบัดด้วย HBOT สามารถส่งผลต่อประสิทธิภาพของยาปฏิชีวนะบางชนิด งานวิจัยชี้ให้เห็นว่ายาฆ่าเชื้อแบคทีเรียบางชนิด เช่น เบต้า-แลคแทม ฟลูออโรควิโนโลน และอะมิโนไกลโคไซด์ ไม่เพียงแต่ทำงานผ่านกลไกภายในเท่านั้น แต่ยังอาศัยกระบวนการเผาผลาญแบบใช้ออกซิเจนของแบคทีเรียด้วย ดังนั้น การมีอยู่ของออกซิเจนและลักษณะการเผาผลาญของเชื้อโรคจึงมีความสำคัญอย่างยิ่งในการประเมินผลการรักษาของยาปฏิชีวนะ
มีหลักฐานสำคัญที่แสดงให้เห็นว่าระดับออกซิเจนต่ำสามารถเพิ่มความต้านทานของเชื้อ Pseudomonas aeruginosa ต่อยา piperacillin/tazobactam และสภาพแวดล้อมที่มีออกซิเจนต่ำยังส่งผลให้เชื้อ Enterobacter cloacae มีความต้านทานต่อยา azithromycin เพิ่มขึ้น ในทางกลับกัน สภาวะที่มีออกซิเจนต่ำบางอย่างอาจเพิ่มความไวของแบคทีเรียต่อยาปฏิชีวนะกลุ่มเตตราไซคลิน การบำบัดด้วยออกซิเจนความดันสูง (HBOT) เป็นวิธีการรักษาเสริมที่มีประสิทธิภาพ โดยการกระตุ้นกระบวนการเผาผลาญแบบใช้ออกซิเจนและเติมออกซิเจนให้กับเนื้อเยื่อที่ติดเชื้อซึ่งอยู่ในสภาวะขาดออกซิเจน ส่งผลให้เชื้อโรคมีความไวต่อยาปฏิชีวนะเพิ่มขึ้น
ในการศึกษาทางคลินิกก่อนหน้านี้ การใช้ HBOT ร่วมกับยาโทบราไมซิน (20 มก./กก./วัน) โดยให้วันละสองครั้ง ครั้งละ 8 ชั่วโมง ที่ความดัน 280 kPa ช่วยลดปริมาณเชื้อแบคทีเรียในภาวะเยื่อบุหัวใจอักเสบจากเชื้อ Staphylococcus aureus ได้อย่างมีนัยสำคัญ ซึ่งแสดงให้เห็นถึงศักยภาพของ HBOT ในฐานะการรักษาเสริม การวิจัยเพิ่มเติมพบว่า ภายใต้อุณหภูมิ 37°C และความดัน 3 ATA เป็นเวลา 5 ชั่วโมง HBOT ช่วยเพิ่มประสิทธิภาพของยาอิมิเพเนมในการรักษาเชื้อ Pseudomonas aeruginosa ที่ติดเชื้อในแมโครฟาจได้อย่างเห็นได้ชัด นอกจากนี้ การใช้ HBOT ร่วมกับยาเซฟาโซลินยังพบว่ามีประสิทธิภาพมากกว่าในการรักษาโรคกระดูกอักเสบจากเชื้อ Staphylococcus aureus ในสัตว์ทดลอง เมื่อเทียบกับการใช้ยาเซฟาโซลินเพียงอย่างเดียว
การบำบัดด้วยออกซิเจนความดันสูง (HBOT) ยังช่วยเพิ่มฤทธิ์ฆ่าเชื้อแบคทีเรียของซิโปรฟลอกซาซินต่อไบโอฟิล์มของ Pseudomonas aeruginosa อย่างมีนัยสำคัญ โดยเฉพาะอย่างยิ่งหลังจากได้รับการบำบัดเป็นเวลา 90 นาที การเพิ่มประสิทธิภาพนี้เกิดจากการสร้างอนุมูลอิสระออกซิเจน (ROS) ภายในเซลล์ และแสดงให้เห็นถึงความไวที่เพิ่มขึ้นในสายพันธุ์กลายพันธุ์ที่บกพร่องของเอนไซม์เพอร์ออกซิเดส
ในแบบจำลองของเยื่อหุ้มปอดอักเสบที่เกิดจากเชื้อ Staphylococcus aureus ที่ดื้อต่อเมธิซิลลิน (MRSA) ผลร่วมกันของแวนโคไมซิน ไทโคพลาลิน และไลเนโซลิด ร่วมกับการบำบัดด้วยออกซิเจนความดันสูง (HBOT) แสดงให้เห็นถึงประสิทธิภาพที่เพิ่มขึ้นอย่างมีนัยสำคัญในการต่อต้าน MRSA เมโทรนิดาโซล ซึ่งเป็นยาปฏิชีวนะที่ใช้กันอย่างแพร่หลายในการรักษาการติดเชื้อแบบไม่ใช้ออกซิเจนและแบบหลายชนิดที่รุนแรง เช่น การติดเชื้อที่เท้าของผู้ป่วยเบาหวาน (DFIs) และการติดเชื้อที่แผลผ่าตัด (SSIs) แสดงให้เห็นถึงประสิทธิภาพในการต้านจุลชีพที่สูงขึ้นภายใต้สภาวะที่ไม่ใช้ออกซิเจน จึงจำเป็นต้องมีการศึกษาเพิ่มเติมเพื่อสำรวจผลเสริมฤทธิ์ต้านแบคทีเรียของ HBOT ร่วมกับเมโทรนิดาโซลทั้งในร่างกายและในหลอดทดลอง
ประสิทธิภาพการต้านจุลชีพของ HBOT ต่อแบคทีเรียดื้อยา
ด้วยวิวัฒนาการและการแพร่กระจายของเชื้อแบคทีเรียดื้อยา ยาปฏิชีวนะแบบดั้งเดิมมักจะเสื่อมประสิทธิภาพลงเมื่อเวลาผ่านไป นอกจากนี้ การบำบัดด้วยออกซิเจนความดันสูง (HBOT) อาจมีความสำคัญในการรักษาและป้องกันการติดเชื้อที่เกิดจากเชื้อโรคดื้อยาหลายชนิด โดยทำหน้าที่เป็นกลยุทธ์ที่สำคัญเมื่อการรักษาด้วยยาปฏิชีวนะล้มเหลว มีการศึกษาจำนวนมากรายงานถึงผลการฆ่าเชื้อแบคทีเรียที่สำคัญของ HBOT ต่อแบคทีเรียดื้อยาที่มีความสำคัญทางคลินิก ตัวอย่างเช่น การบำบัดด้วย HBOT เป็นเวลา 90 นาทีที่ความดัน 2 ATM ช่วยลดการเจริญเติบโตของ MRSA ได้อย่างมาก นอกจากนี้ ในแบบจำลองเชิงอัตราส่วน HBOT ยังช่วยเพิ่มฤทธิ์ต้านเชื้อแบคทีเรียของยาปฏิชีวนะต่างๆ ต่อการติดเชื้อ MRSA รายงานต่างๆ ยืนยันว่า HBOT มีประสิทธิภาพในการรักษาโรคกระดูกอักเสบที่เกิดจาก Klebsiella pneumoniae ที่ผลิต OXA-48 โดยไม่จำเป็นต้องใช้ยาปฏิชีวนะร่วมด้วย
โดยสรุปแล้ว การบำบัดด้วยออกซิเจนความดันสูงเป็นแนวทางที่ครอบคลุมในการควบคุมการติดเชื้อ ช่วยเสริมสร้างการตอบสนองของระบบภูมิคุ้มกัน พร้อมทั้งเพิ่มประสิทธิภาพของยาต้านจุลชีพที่มีอยู่ ด้วยการวิจัยและพัฒนาอย่างครอบคลุม จึงมีศักยภาพที่จะช่วยลดผลกระทบจากภาวะดื้อยาปฏิชีวนะ และเป็นความหวังในการต่อสู้กับการติดเชื้อแบคทีเรียอย่างต่อเนื่อง
วันที่เผยแพร่: 28 กุมภาพันธ์ 2568

